
por Allcrom
Monitoramento de Adesão Medicamentosa na Leucemia usando Microamostragem
Um artigo de Marina V. Antunes e outros pesquisadores, em várias instituições no Brasil, publicado na edição de janeiro de 2023 do Journal of Pharmaceutical and Biochemical Analysis, validou um ensaio que mede o Mesilato de Imatinibe e seu principal metabólito a partir de microamostras de sangue por punção digital para Monitoramento Terapêutico de Medicamentos (TDM, sigla em inglês para Therapeutic Drug Monitoring). O artigo é intitulado “Microamostragem volumétrica de sangue seco para monitorar a terapia com Mesilato de Imatinibe: Desenvolvimento de método e aplicação clínica em pacientes com Leucemia Mieloide Crônica.”

O estudo forneceu aos voluntários Dispositivos de microamostragem Mitra® baseados na Tecnologia VAMS® para autocoleta de amostras de sangue. Os dispositivos portáteis de microamostragem mostraram alta aceitação da amostragem capilar pelos voluntários com avaliações de dor muito baixas.
Leucemia Mielóide Crônica e Imatinibe
A Leucemia Mieloide Crônica (LMC) é um câncer no sangue de células-tronco hematopoiéticas que leva ao aumento da hiperplasia mieloide da medula óssea. A detecção do cromossomo Philadélfia (Ph+), uma anormalidade genética do cromossomo 22 através da formação de um gene de fusão chamado BCR-ABL, é usada para confirmar o diagnóstico.
O Mesilato de Imatinibe (MI) é um fármaco inibidor da Tirosina Quinase (TKI, sigla em inglês para Tyrosine Kinase Inhibitor) usado como tratamento de primeira linha da Leucemia Mieloide Crônica em pacientes que têm o cromossomo Ph+. O Imatinibe foi inventado pelo bioquímico Micholas Lyndon, que trabalha na Ciba-Geigy (agora Novartis), e o medicamento foi aprovado pela Food and Drug Administration (FDA) dos EUA em maio de 2001. O Imatinibe atua para inibir várias Tirosinas Quinases (TK, sigla em inglês para Tyrosine Kinase), incluindo a TK produzida a partir do gene de fusão BCR-ABL, que atua para desligar as vias de sinalização que promovem a Leucemogênese.
O MI é metabolizado principalmente pelo sistema do Citocromo P450, e o metabólito primário é um derivado N-desmetilado (Nim) que tem atividade farmacológica semelhante à da droga original. De acordo com estudos anteriores citados no artigo, o MI tem uma janela terapêutica estreita, onde as concentrações plasmáticas acima de 1000 ng/ml1 têm uma maior probabilidade de respostas terapêuticas e moleculares.
De fato, o artigo citou um estudo anterior em que o aumento da ingestão de MI de 90 para 100% aumentou a probabilidade de resposta ao tratamento em até 2 vezes. Por outro lado, concentrações plasmáticas acima de 3000 ng/ml1 têm sido associadas a efeitos colaterais adversos de MI, como Neutropenia e Edema.
A necessidade do monitoramento terapêutico (TDM) de MI
A Leucemia Mieloide Crônica (LMC) é um câncer no sangue de células-tronco hematopoiéticas que leva ao aumento da hiperplasia mieloide da medula óssea. A detecção do cromossomo Philadélfia (Ph+), uma anormalidade genética do cromossomo 22 através da formação de um gene de fusão chamado BCR-ABL, é usada para confirmar o diagnóstico.

O Mesilato de Imatinibe (MI) é um fármaco inibidor da Tirosina Quinase (TKI, sigla em inglês para Tyrosine Kinase Inhibitor) usado como tratamento de primeira linha da Leucemia Mieloide Crônica em pacientes que têm o cromossomo Ph+. O Imatinibe foi inventado pelo bioquímico Micholas Lyndon, que trabalha na Ciba-Geigy (agora Novartis), e o medicamento foi aprovado pela Food and Drug Administration (FDA) dos EUA em maio de 2001. O Imatinibe atua para inibir várias Tirosinas Quinases (TK, sigla em inglês para Tyrosine Kinase), incluindo a TK produzida a partir do gene de fusão BCR-ABL, que atua para desligar as vias de sinalização que promovem a Leucemogênese.
Os autores do estudo sublinharam os benefícios da coleta remota e domiciliar de amostras capilares secas, como uma abordagem mais confortável e conveniente para os pacientes. Essa abordagem de amostragem também é mais fácil para os coordenadores do estudo, porque as amostras de sangue seco podem ser enviadas por postagem padrão para um laboratório central, sem necessidade de cadeia fria ou logística complicada – apenas um envelope de remessa e postagem padrão.
TDM remoto pode ser ideal para medição eficaz de Imatinibe
Em termos de medição farmacocinética, as abordagens de coleta domiciliar (usando dispositivos Mitra® com Tecnologia VAMS®, por exemplo) permitem mais flexibilidade para que as amostras sejam coletadas em diferentes momentos. Essa flexibilidade inspirou o grupo de pesquisa a desenvolver um ensaio de VAMS® para medir tanto o MI, quanto seu principal metabólito como uma possível ferramenta para coleta remota de amostras de MI.
Uma razão para a escolha de VAMS® foi que um ensaio bem-sucedido para medir MI havia sido desenvolvido anteriormente como parte de um painel de 8 TKIs. Para avançar ainda mais o trabalho que já havia sido relatado, o grupo iniciou o desenvolvimento de um método para medir o principal metabólito (Nim) e o medicamento original (MI) de pacientes com LMC. Um resultado importante do novo estudo foi entender o impacto da amostragem remota e domiciliar na satisfação do paciente e na adesão ao tratamento.
Métodos e Descobertas do Estudo de Adesão ao Medicamento
- Validado ensaio de LC-MS/MS de acordo com as diretrizes da Agência Europeia de Medicamentos, da Food & Drug Administration dos EUA e da Associação Internacional de Monitoramento de Medicamentos Terapêuticos e Toxicologia Clínica.
- Os pesquisadores observaram uma série de destaques importantes relativos aos Dispositivos Mitra®, incluídos abaixo.
- A extração de MI e Nim a partir das pontas VAMS® foi realizada usando uma abordagem de precipitação de Proteínas envolvendo 0,1% de Ácido Fórmico em Água, Acetonitrila e resfriamento a – 20 °C.
- O armazenamento de microamostras de VAMS® em temperatura ambiente e 45°C (para imitar condições tropicais) ao longo de 3, 6, 14 e 21 dias foi avaliado. Verificou-se que tanto o Nim quanto o MI eram estáveis por até duas semanas, mesmo na temperatura mais alta. O grupo observou que as amostras poderiam ser transportadas por até duas semanas sem cadeia fria de armazenamento.
- Ao olhar para uma faixa de níveis de hematócrito (Ht = 25-55%), um rendimento médio de extração de 93% para MI e 91% para Nim foi observado com um viés de apenas 10%. Da mesma forma, o impacto da precisão não foi afetado adversamente pela faixa de Ht testada. Isso foi observado no estudo anterior que os autores citaram em seu artigo.
Processos Clínicos
- Os pacientes com LMC (n=33) foram recrutados e treinados para coleta de microamostras de sangue por punção digital usando Dispositivos Mitra® com Tecnologia VAMS®, antes de voltar para casa com kits para autocoleta.
- De acordo com as respostas fornecidas em um questionário de Morisky-Green, 65,6% dos pacientes apresentaram alta adesão, 18,8% apresentaram adesão moderada e 15,6 relataram baixos níveis de adesão.
- Usando uma razão de sangue para plasma de 1,28 como um multiplicador, o grupo foi capaz de obter uma concentração plasmática estimada. Curiosamente, as concentrações de MI nos grupos aderentes e não aderentes não foram estatisticamente diferentes.
- No entanto, os pesquisadores relataram: “Os pacientes aderentes tiveram maiores razões [MI]/dose (P = 0,05), com uma mediana (P25-P75) de 2,38 (1,68-3,41) quando comparados aos indivíduos com algum nível de não adesão, que apresentaram uma mediana de 1,54 (0,91-2,86).”
O feedback fornecido pelos voluntários do estudo através do questionário mostrou alguns resultados promissores:
- 91% seriam capazes de realizar testes em casa, se disponível.
- 18 apresentaram preferência pela autocoleta, 10 pela coleta in loco (na clínica) e 5 não tiveram preferência.
- Em comparação com a punção venosa, 87% sentiram menos desconforto usando VAMS®.
De acordo com uma tabela padrão de escores de dor (0-10, onde 0 = sem dor e 10 = a pior dor possível) ao usar dispositivos Mitra® com VAMS® para coletar amostras de sangue por punção digital, o seguinte foi registrado:
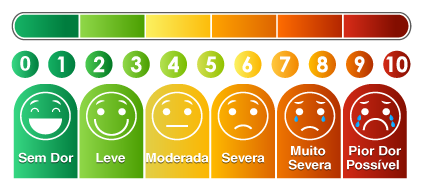
- 45,2% não relataram dor.
- 16,2 relataram pouca dor.
- 38,7 relataram dor leve entre os escores 1 e 2.
- 97% sentiram que foram capazes de realizar a autocoleta.
- 31 dos 33 voluntários do estudo coletaram com sucesso pelo menos 1 amostra com um volume adequado de sangue e 23 coletaram todas as 3 amostras corretamente.
Conclusões do Autor do Estudo de Adesão ao Medicamento
- O grupo de pesquisa desenvolveu um ensaio LC-MS/MS suficiente para medir MI e Nim.
- O grupo de pesquisa concluiu que as principais vantagens do uso de VAMS® incluíram um procedimento de coleta minimamente invasivo, permitindo a coleta em casa, a estabilidade do analito e a redução dos custos de armazenamento e transporte.
Comentários
Este artigo demonstra a importância de desenvolver ensaios de TDM de alta qualidade para implantação potencial em amplas áreas geográficas, onde o tamanho do país torna desafiador e caro o transporte de amostras líquidas coletadas tradicionalmente.
Os resultados do questionário do estudo demonstraram que 87% dos voluntários sentiram menos desconforto usando Dispositivos Mitra® com Tecnologia VAMS® em comparação com a punção venosa. Todos relataram nenhuma dor ou pouca dor no escore de dor relacionado à punção dos dedos para coletar as amostras de sangue. Os resultados deste estudo podem negar a necessidade de recorrer a outras soluções de amostragem de sangue mais caras disponíveis.
Para mais informações entre em contato com [email protected]

